“动物重大疫病新型疫苗研发创新团队”在《PLOS Pathogens》上发表重要研究成果
近日,我校动物医学院“动物重大疫病新型疫苗研发创新团队”在国际著名病原微生物期刊《PLOS Pathogens》在线发表了题为“PCV2 targets cGAS to inhibit type I interferon induction to promote other DNA virus infection”的研究论文。揭示了猪圆环病毒2型(PCV2)靶向抑制cGAS-STING通路的活化进而促进其它DNA病毒的感染机制。博士生王振宇和陈璟为论文的共同第一作者,童德文教授和黄勇教授为论文的共同通讯作者。
PCV2是危害全球养猪业最为严重的病原之一,其典型的致病特征是诱导宿主免疫持续抑制,继发多种病原感染。宿主天然免疫反应在抵抗病毒入侵过程中发挥着重要作用,I型干扰素系统是机体在组织细胞水平抵抗各种感染的重要防御体系,是机体最先发挥防御作用的天然免疫反应部分。病毒逃逸宿主天然免疫被认为是其重要的致病机理之一,也是病毒成功建立感染必须要跨过的一道屏障,但目前有关PCV2逃逸天然免疫的机理还不清楚,阐明该机制对于认识PCV2抑制宿主免疫的机理以及做好临床防控具有重要意义。
cGAS-STING通路是DNA病毒诱导I型干扰素产生的主要通路,研究发现PCV2感染可以有效抑制cGAS-STING通路的活化,进而促进其它DNA病毒的感染。PCV2在感染早期通过宿主互作蛋白gC1qR激活Akt抑制cGAS的催化活性,减少信使分子cGAMP产生,在感染后期,促进cGAS发生多聚泛素化,并通过HDAC6分子募集多聚泛素化的cGAS,最终转运至自噬溶酶体进行降解。研究阐明了PCV2感染对宿主天然免疫的影响及相应的分子机制,为全面系统地认知PCV2感染诱发多重感染形成的机制提供新的见解,并为PCV2新型疫苗研发和抗病育种提供靶点。
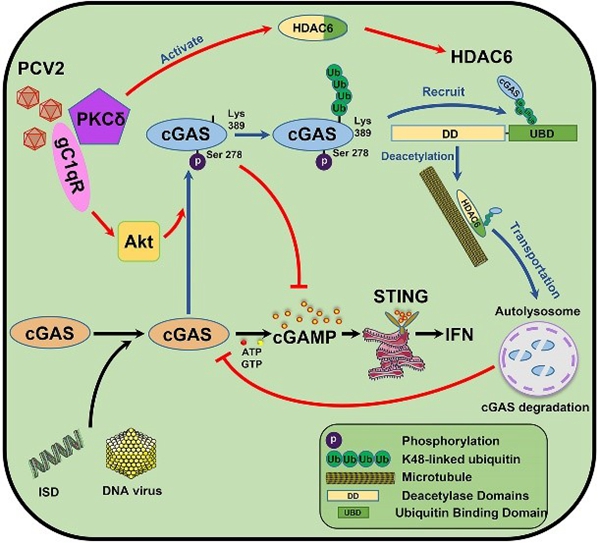
PCV2通过gC1qR介导的催化活性抑制和HDAC6介导的自噬降解靶向作用于cGAS抑制I型干扰素的产生
据悉,“动物重大疫病新型疫苗研发创新团队”自2011年开始聚焦PCV2的致病机制与宿主免疫机制研究,重点关注病毒与宿主相互作用分子机制及其与致病性的关系,取得了一系列的研究成果,前期已在《Journal of Virology》(双一流B类期刊、Top期刊)、《The Journal of Immunology》(双一流B类期刊、Top期刊)、《Frontiers in Microbiology》(Top期刊)、《Veterinary Research》(Top期刊)等领域内权威期刊发表研究论文10余篇。
该研究得到国家自然科学基金面上项目(31972686、31872447)、陕西省重点研发计划(2018ZDCXL-NY-02-07、2020NY-010)、中央高校基本科研基金(2452017023)的资助。
原文链接:https://journals.plos.org/plospathogens/article?id="10.1371/journal.ppat.1009940
